SARS-CoV-2 & Influenza A/B Antigen Combo Rapid Test Kit (LFIA) Instructions For Use
Product Name SARS-CoV-2 & Influenza A/B Antigen Combo Rapid Test Kit (LFIA)
Product Types And Specifications Types:1/1/m Test astettctbag Kit:20pcs/box 50 pcsbor, 100 pcs/box
Intended use
Medomics SARS-CoV-2 & Influenza A/B Antigen Combo Rapid Test Kit (LFIA) is used to qualitatively detectSARS-CoV-2, Influenza A and Influenza B virus antigens in human samples in vitro.
Coronavirus (CoV) belongs to the order Nidovirales under the Coronaviridae family with 4 genera:a, ß Y and8. The a and ß genera are only pathogenic to mammals, while Y and 8 genera mainly cause bird infections.CoV is mainly transmitted through direct contact with secretions or through aerosols and droplets. There isalso evidence supporting fecal-oral transmission.
7 kinds of human coronaviruses (HCoV) that cause human respiratory diseases have been identified so far,including: HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1, SARS -CoV, MERS-CoV and SARS-CoV-2.SARS-CoV-2 is one of the most contagious viral pathogens that causes human respiratory tract infections(RTI). Currently, the patients infected by SARS-CoV-2 are the main source of infection; asymptomatic infectedpeople can also be an infectious source. Based on the current epidemiological investigation, the incubationperiod is 1 to 14 days, mostly 3 to 7 days. The clinical manifestations include fever, fatigue, cough and othersymptoms, accompanied by dyspnea, which can rapidly develop into life- threatening severe pneumonia,respiratory failure, acute respiratory vesicle syndrome, septic shock, multiple organ failure, and severemetabolic acid-base imbalance.
Influenza, usually called flu, is an acute respiratory infection caused by Influenza virus. It is highly contagious.It is mainly spread through coughing and sneezing. It usually breaks out in spring and winter. It is mainlydivided into Influenza A and B Influenza virus . Influenza A viruses are highly variable, followed by InfluenzaB viruses. Therefore, Influenza A viruses are more prevalent and severe, followed by Influenza B viruses.Obvi-ous or mild upper respiratory tract infections rarely cause epidemics.Influenza A includes H1N1, H3N2,H5N1, H7N9, and Influenza B includes Influenza B (Victoria) and Influenza B (Yamagata).
Test Principle
Medomics SARS -CoV-2 & Influenza A/B Antigen Combo Rapid Test Kit (LFIA) uses a double antibodysandwich method to detect SARS. CoV-2 and Influenza A/B by olloida gold immunochromatography.
The SARS-CoV-2 antigen detection test strip contains (1) colloidal gold-labeled anti-SARS-CoV-2 antibody,(2) one detection line (T line) fixed on a nitrocellulose membrane and a quality control line(C line). FixT withanti-SARS-CoV-2 antibody to detect the SARS-CoV-2. The quality control antibody is fixed on the C line.When the appropriate amount of test sample treated with lysis buffer is added to the sample well of the teststrip, the sample will move forward along the test strip by capillary action. If the sample containsSARS-CoV-2 antigen, and concentration of antigens is higher than the limit of detection, the antigen willbind to the colloidal gold-labeled anti- SARS -CoV-2 antibody. The immune complex will be captured by theanti- SARS CoV-2 antibody immobilized on the membrane, forming a red T line, indicating a positive resultfor the SARS- CoV-2. If the sample contains no the SARS-CoV-2 antigen or the antigen concentration is lowerthan the limit of detection, a negative result is displayed.
Influenza A/B antigen test strip contains(1) colloidal gold-labeled anti-lnfluenza A antibody andanti-Influenza B antibody, (2) antibody specific to the Influenza A and Influenza B is separately coated on theA line and B line,a quality control line is C line. The A line detect Influenza A virus and the B line detectInfluenza B virus. When an appropriate amount of test sample treated with the lysis buuer is added to thesample well of the Influenza A/B antigen test strip, the Influenza A(and or Influenza B) antigen ofextracted sample reacts with the antibody to Influenza A (and or Influenza B )that are coated ontoconjugation pad. The mixture react with the antibody to Influenza A (and or Influenza B) on the membraneby capillary action and generate one or two red lines in the test regions. The presence of this red line in eitheror both of the test regions indicates a positive result. To serve as a procedural control, C line will alwaysappear in the control region if the test has performed properly.
Additionally, the test strip also contains a quality control line(C line). The C line should be formed to indicatethat the sample has been transported properly through the membrane regardless of whether samplecontains antigen or not. If the C line does not appear, it indicates that the test result is invalid and the sampleneed to retest.
Contents of the Kit
Type I test kit contains test cassettes, sterile swabs, sampling tubes, droppers, a vial containing lysis bufferand instructions for use.
Тууре П tеѕt kіt соntаіnѕ tеѕt саѕѕеttеѕ, ѕtеrіlе ѕwаbѕ, ѕаmрlіng tubеѕ соntаіnіng іndіvіduаl lуѕіѕ buffеr,droppers and instructions for use.
Type Ш test kit contains test cassettes,sterile swabs,sampling tubes, buffer capsules containing
individual lysis buffer droppers and instructions for use.
· Test cassette: contains the SARS-CoV-2 test strip, Influenza A/B test strip and a plastic cassette casing.
The SARS-CoV-2 test strip contains: colloidal gold-labeled anti-SARS-CoV-2 antibody, nitrocellulosemembrane (C line is fixed with anti-mouse lgG antibody, and T line is fixed with another anti-SARS-CoV-2antibody).
The Influenza A/B test strip contains: colloidal gold-labeled anti-lnfluenza A antibody and anti-lnfluenza Bantibody, nitrocellulose membrane (C line is fixed with anti-mouse lgG antibody, and another anti-InfluenzaA antibody and anti-lnfluenza B antibody are fixed on the A line and B line respectively).
Warnings and Precautions
●This test kit is used for in vitro diagnosis only.
●This test kit should be used by qualified personnel with professional experience or proper training.·' This test kit should be used within 1 hour after opening the package, and samples from transportmedia will reduce sensitivity. The test cassette should not be used if being wet or polluted.
●Proper protection should be taken during testing to avoid splashing when adding sample.
●Dispose of all used or damaged test cassettes, capillary samplers, or other kit components as biohazardous materials.
●Negative results do not rule out SARS CoV 2, Influenza A and Influenza B infections, especially in peoplewho have been exposed to these viruses.
Storage Instructions
The test kit should be stored away from direct sunlight at 2C to 30 C with a shelf-life of 24 months. Do notfreeze.
Sample Requirements
Note: One test cassette can only be used to test one throat swab or one oropharyngeal swab. Nasopharyn-geal swab or throat swab should be collected according to actual needs.
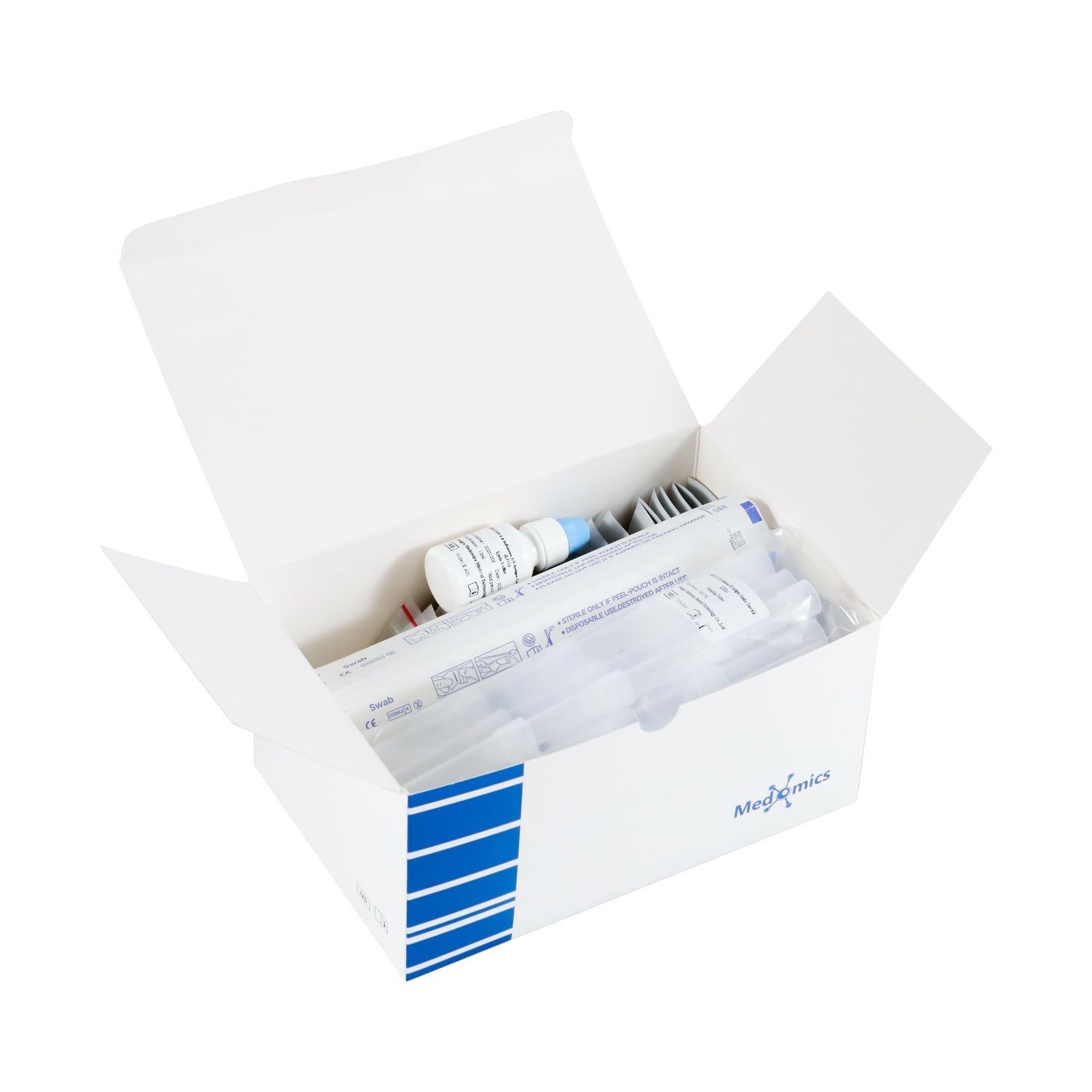
●Nasopharyngeal secretion collection: Take out a swab from the pouch. Insert the swab into one of the patient'snostrils until it reaches the posterior nasopharynx where there is the most secretion, gently rotate and rub the swabover the surface of the posterior nasopharynx for several times before taking it out.
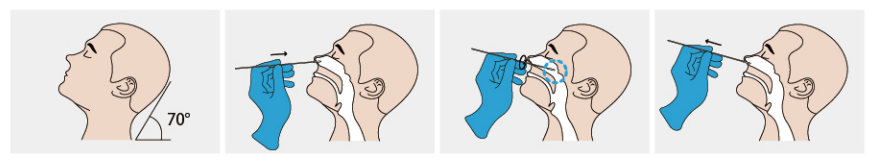
●Oropharyngeal secretion collection:Insert the whole swab completely into the throat from the mouth,centering on the throat wall and the reddened area of the palate tonsil, wipe both sides of the pharyngeal tonsiland posterior pharyngeal wall with moderate force. Try to avoid the tongue before taking it out.
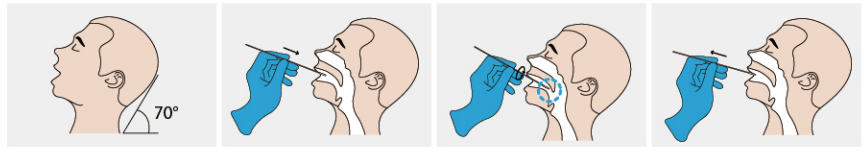
Sample should be treated with lysis buffer provided in this kit as soon as possible after collection. If the samplecannot be processed immediately, it should be stored immediately in a dry, sterilized and strictly sealed plastictube. It can be stored at 2C -8'C for 8 hours. Could be stored at -70 C for long term storage.
Test Procedure
Do not open pouch until ready to use. Prep necessary materials: Timer Tube rack for sampling tubes andspecimens Any necessary personal protective equipment.
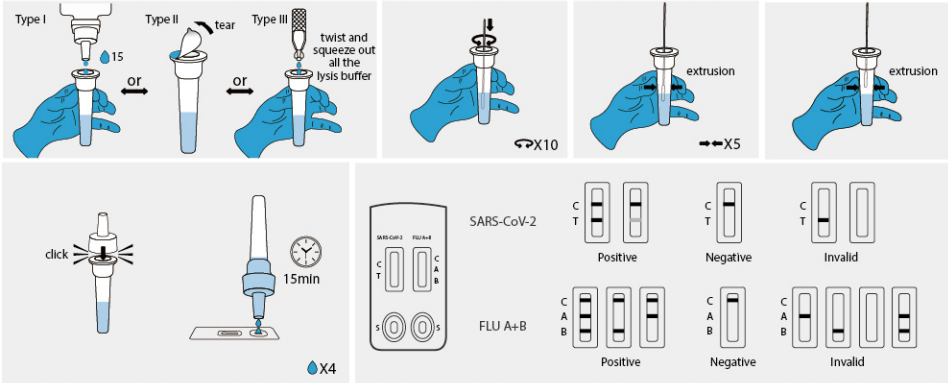
(1) Sampling: Vertically add 15 drops (approximately 350 uL) lysis buffer into the sampling tube from vial oropen the seal of the sampling tube containing lysis buffer or twist and squeeze out all the lysis buffer intothe sampling tube from capsule. Insert the swab (after collection) into the buffer. Rotate the swab againstthe inner tube wall 10 times and squeeze the swab from the outer tube wall 5 times to completely dissolvethe sample in the buffer, then move the swab up until it is resting on the sample solution, squeeze the swabfrom the outer tube wall in order to leave the sample in the tube as much as possible. Remove and discardthe swab, cover the tube with the dropper.
2 Test procedures: Open the aluminum foil pouch, take out the test cassette and lay it on a clean flat surface,then mark the patient ID or sample number and add 4 drops (approximately 100 uL) processed sampleextract into the sample well.
The result should be observed within 15 -20 minutes. Results observed after 20 minutes are invalid.
Test Method Limitations
● The accuracy of the test is dependent on the quality of the sample. Improper sampling or storage, usingexpired samples or repeated frozenthawed samples can affect the test result. Test results can also be affected by temperature and humidity.
● Low concentrations of SARS-CoV-2, Influenza A and Influenza B antigens in the sample may cause
negative results, SO the possibility of infection cannot be completely ruled out.
● Some medication (e.g. high concentrations of over-the- counter (OTC) or prescription medication
such as nasal spray) in the collected samples may interfere with the test result. Please perform the test again if the result is in doubt.
●This product is only for qualitative testing and the specific concentration of each indicator must bemeasured using other quantitative methodologies.
●The results of this test are for clinical reference only and should not be the only basis for diagnosis.Results should be used in combination with clinical observations and other testing methods.
Display of Results/Expected Values
. SARS-CoV-2 negative result: If only the quality control line (C line) appears and the test line (T line) isinvisible, the sample does not contain the SARS· -CoV-2 antigen or the antigen concentration is lower thanthe limit of detection, then the result is negative.
· SARS-CoV-2 positive result: If the quality control line (C line) and the test line (T line) appear at the sametime, it means that the SARS- CoV-2 has been detected and the result is positive.
Influenza A/B negative result : If only the quality control line (C line) appears and the test line (A line and Bline ) is invisible , the sample does not contain Influenza A/B antigen or the antigen concentration is lowerthan the limit of detection, then the result is negative.
Influenza A positive result :lf both the quality control line (C line) and the Influenza A test line (A line) appearat the same time, it means that Influenza A antigen has been detected in the sample and the result ofInfluenza A is positive.
Influenza B positive result : If both the quality control line (C line) and the Influenza B test line (B line) appearat the same time, it means that Influenza B antigen has been detected in the sample and the result ofInfluenza B is positive.
Influenza A/B positive result : If there are three lines of quality control line (C line), Influenza A test line (Aline), Influenza B test line (B line) showing at the same time, it means that Influenza A/B antigen have beendetected in the sample.
. Invalid result: If the C line does not appear, the result is invalid and a new test must be performed again.Note: The intensity of color that the test line area (T line/A line/B line) shows will vary according to theconcentration of SARS CoV-2 antigen, Influenza A antigen and Influenza B antigen. The result should bedetermined on whether the T line is formed or not, and is irrelevant to the color intensity. Therefore, anyintensity of color in the test area (T line/A line/B line) should be considered positive.
External Positive and Negative Controls
Built-in controls include negative control swabs, SARS-CoV-2 positive control swabs, Influenza A viruspositive control swabs and Influenza B virus positive control swabs. When using a negative control swab,only a red line can be seen in the observation window (C line). When using the SARS- CoV-2 positive controlswab, youcan see the red line (C line) and the line (T line) in the observation window at the same time. Whenusing the Influenza A virus positive control swab, you can see the red line (C line) and the line (A line) in theobservation window at the same time. When using the Influenza B virus positive control swab, you can seethe red line (C line) and the line (B line) in the observation window at the same time. If necessary, pleasecontact your local supplier or Medomis to obtain a control swab.
Product Performance
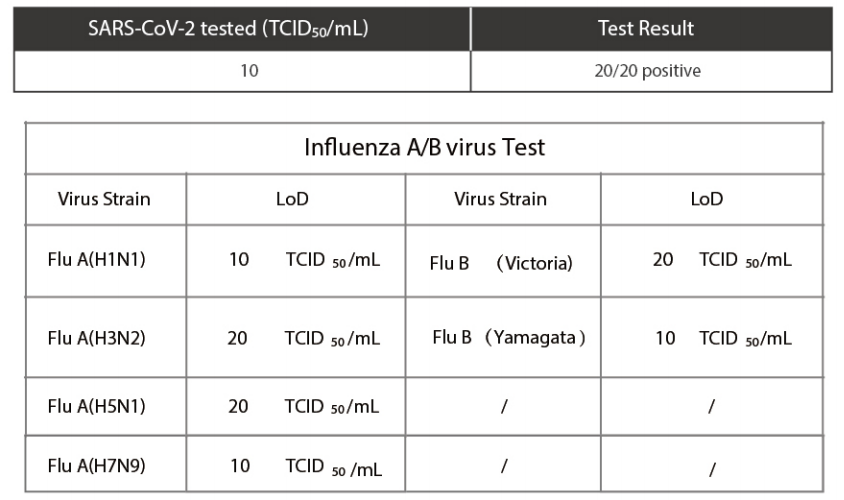
. Limit of Detection - LoD
Limit of Detection (LoD) studies determined the lowest detectable concentration of SARS -CoV-2 at which100% of all (true positive) replicates test positive.
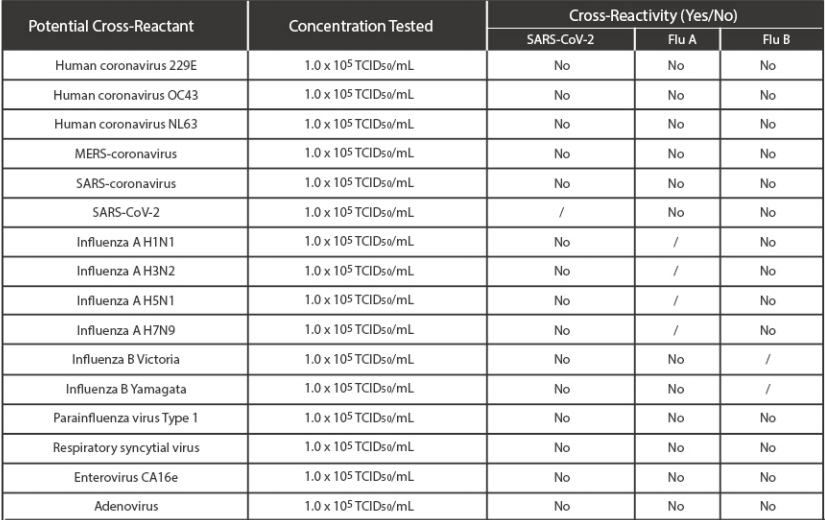
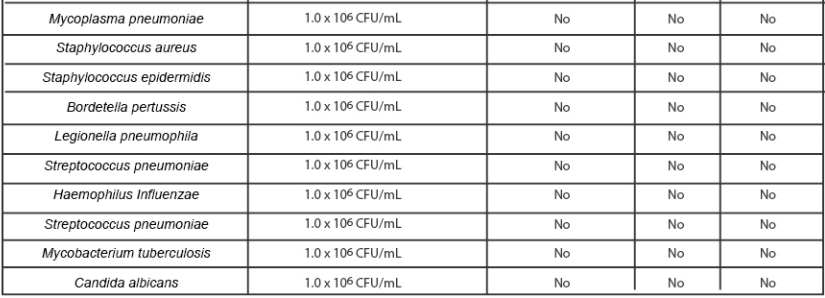
· Cross Reactivity
Cross reactivity and potential interference of Medomics SARS-CoV-2 & Influenza A/B Antigen Combo RapidTest Kit (LFIA) was evaluated by testing commensal and pathogenic microorganisms listed in the followingtable that may be present in the clinical samples. Each of the bacterium, viruses, and yeast were tested intriplicate with no false positive results of SARS-CoV-2 virus, Influenza A and Influenza B.
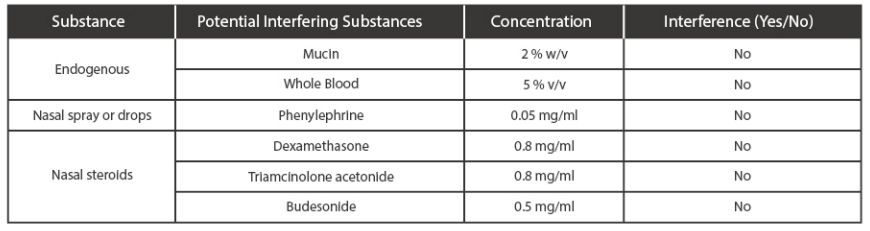
. Endogenous Interfering Substances Effect
A study was performed to evaluated and demonstrated that the endogenous substances naturally presentor drugs that may be artifcially introduced into in clinical samples do not inference with the detection ofSARS-CoV-2 in the Medomics SARS-CoV-2 antigen Test Kit (LFIA) at the concentrations listed below.
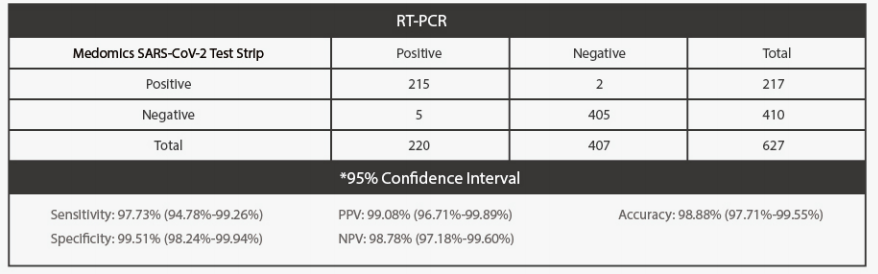
Clinical Performance
The performance of Medomics SARS CoV-2 antigen Test Strip was established with 627 nasopharyngeal swabscollected from clinical patients who were suspected of COVID-19. Two nasopharyngeal swabs were collectedfrom patients and one swab was tested directly using Medomics SARS-CoV-2 antigen Test Strip. The real-timePolymerase Chain Reaction (RT-PCR) assay for the detection of SARS-CoV-2 was used as the comparator methodto confrm the status of samples for this study.
[References]
LY Wang, PR Chen, G W Zheng, et al. Research progress on novel coronavirus test methods. Modern Medicine
and Clinic, 2020, 35(3):411-416.
K Tugba, W Ralph, L Hakho. Molecular and Immunological Diagnostic Tests of COVID-19: Current Status and
Challenges. IScience, 2020, 23 (8): Doi: 10. 1016/j.isci.2020.101406